Connaissances dans le domaine de la technologie médicale
La bases des connaissances en technologie médicale vous donne un aperçu des changements les plus importants de la mise à jour de la norme NF EN ISO 13485. En outre, vous trouverez des informations sur les thèmes de la validation des processus manuels et de la gestion des fournisseurs.
Vous trouverez ici les réponses aux questions suivantes:
- Quels sont les changements apportés par la mise à jour de la norme NF EN ISO 13485?
- Les processus de fabrication manuels dans la technologie médicale doivent-ils être validés?
- Qu'est-ce qu'un fichier d'historique de conception et que faut-il prendre en compte lors de sa création?
- Comment structurer une gestion efficace des fournisseurs pour l'assurance qualité des processus externalisés?
Quels sont les changements apportés par la mise à jour de la norme NF EN ISO 13485?
Extrait des changements les plus importants de la nouvelle norme NF EN ISO 13485 :
- Exigences réglementaires supplémentaires dans les domaines de la validation, de la vérification, de la conception et du développement
- La gestion des risques est mieux prise en compte dans le système de gestion de la qualité
- L'exigence de validation du logiciel est rendue plus explicite
Les processus de fabrication manuels dans la technologie médicale doivent-ils être validés?
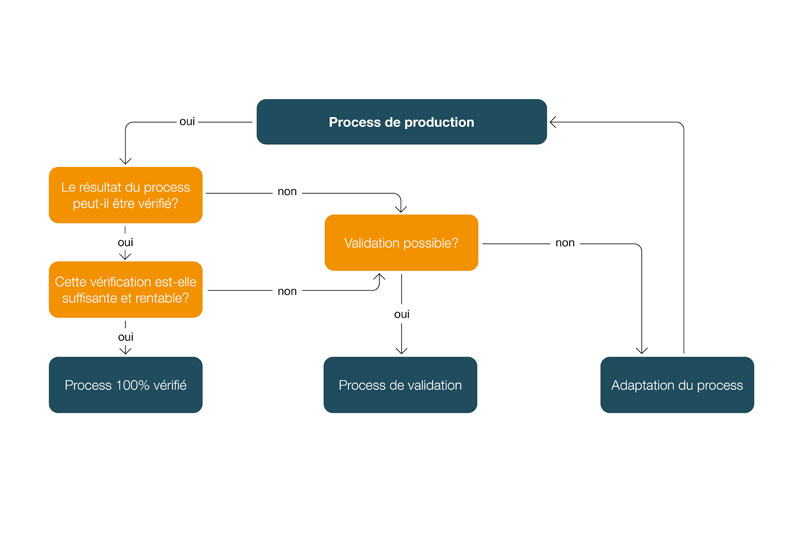
Selon les exigences réglementaires de la norme ISO 13485 et les règlements sur les systèmes de qualité de la FDA, les processus dont les résultats ne sont pas (suffisamment) vérifiés ou ne peuvent pas être vérifiés doivent être validés - que le processus implique ou non des activités manuelles. Les processus manuels doivent donc être considérés exactement de la même manière que les processus automatisés.
Validation des processus manuels dans la technologie médicale
Il en résulte l'arbre de décision suivant pour déterminer si un processus doit être validé:
Qu'est-ce qu'un fichier d'historique de conception et que faut-il prendre en compte lors de sa création?
Le dossier de l'historique de la conception (DHF) représente un enregistrement de l'historique du développement et des résultats du développement d'un dispositif médical. Les éléments spécifiques à documenter sont les suivants:
- Utilisation prévue du produit
- Les exigences et leur détail avec les spécifications
- Description de la conception et fonctionnement
- Plans de construction
- Plans d'essai pour la vérification de la conception
- Plans d'essai pour la validation de la conception
Apprenez-en plus sur le sujet en lisant l'une de nos success stories:
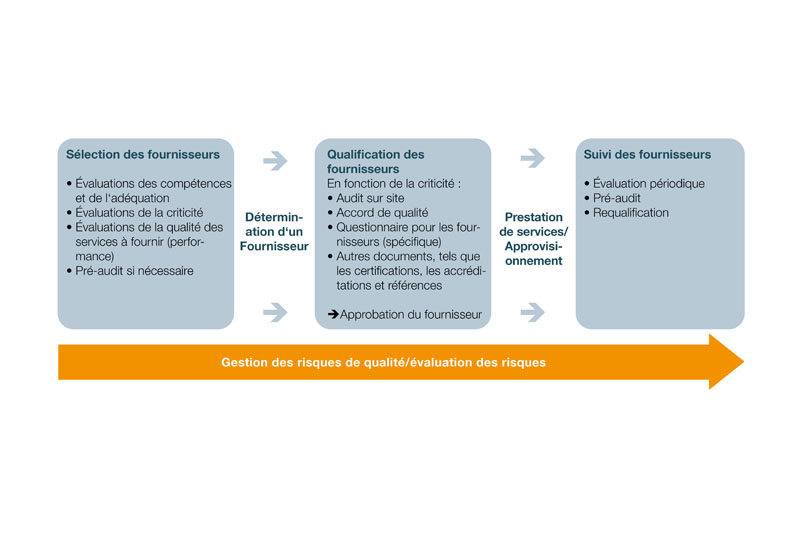
Comment structurer une gestion efficace des fournisseurs pour l'assurance qualité des processus externalisés?
En pratique, la gestion des fournisseurs peut être structurée en plusieurs étapes et comprendre les étapes suivantes:
- Créer un catalogue d'évaluation pour la sélection des fournisseurs
- Effectuer la qualification des fournisseurs
- Sélectionner les fournisseurs
- Mettre en place un suivi des fournisseurs
- Sélection des fournisseurs
- Suivi des fournisseurs
Processus externalisés dans la technologie médicale